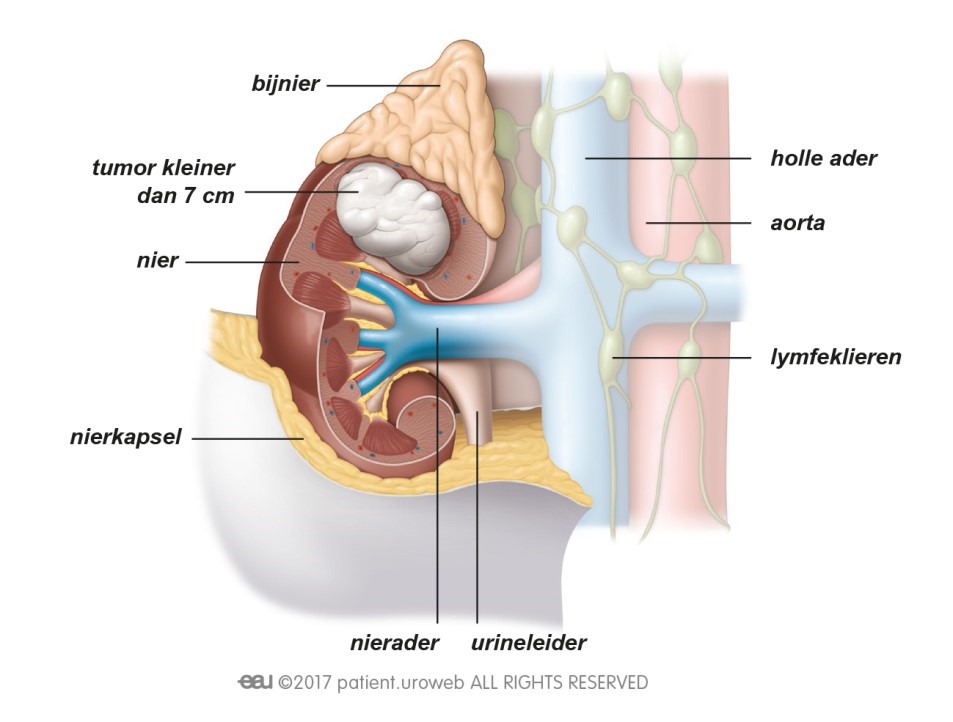
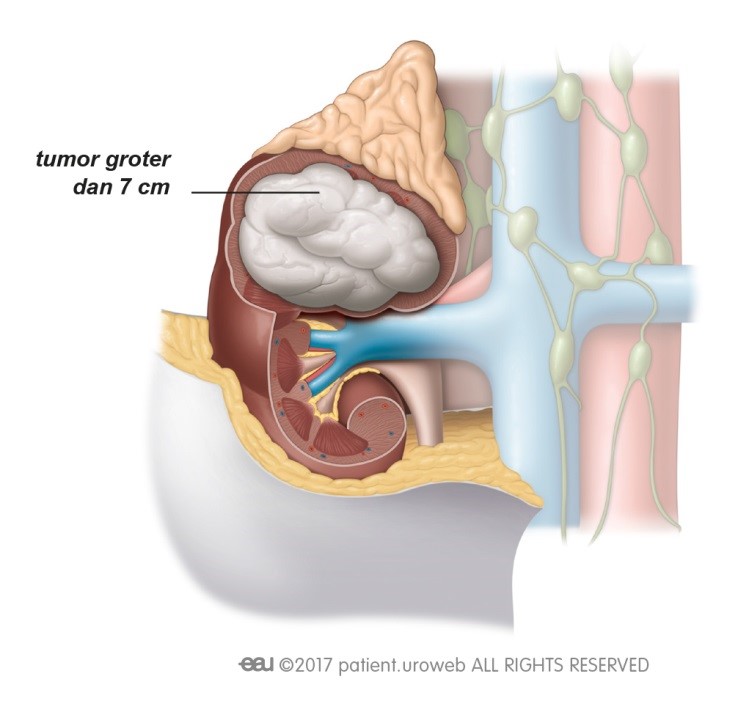
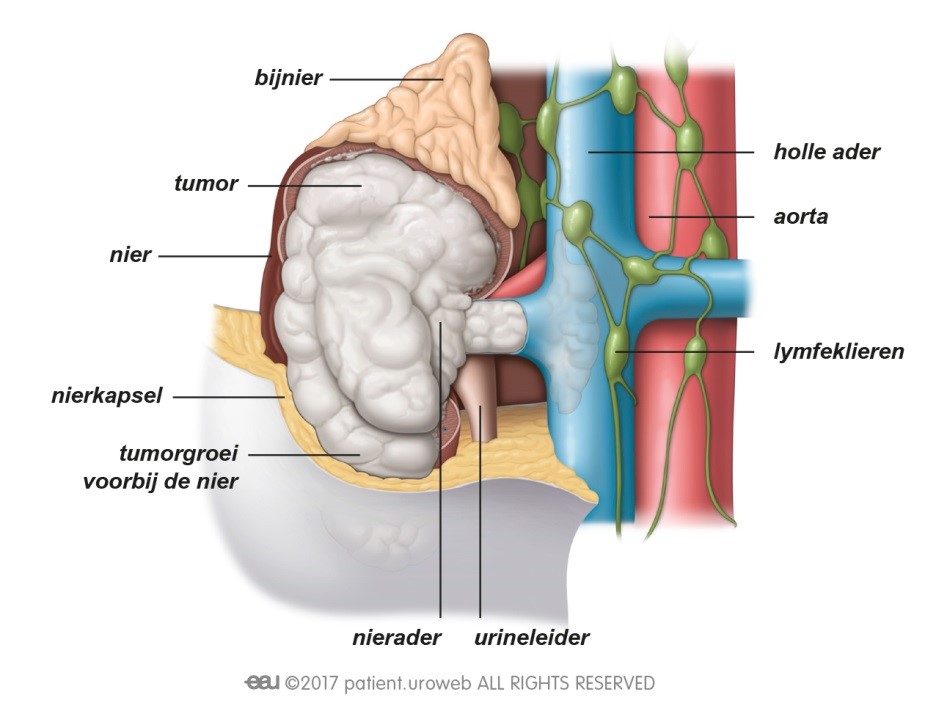
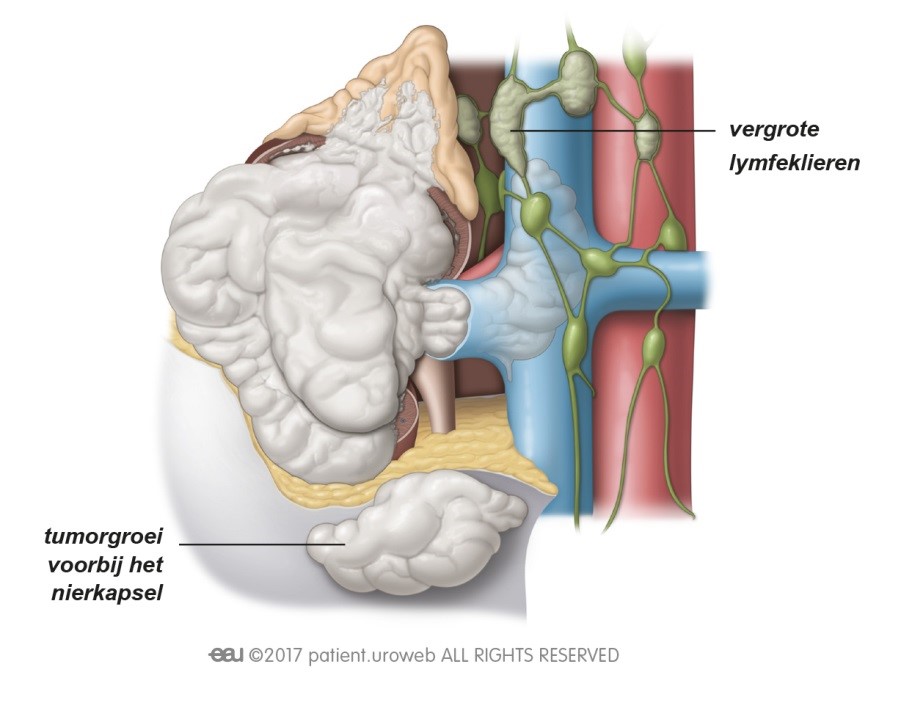
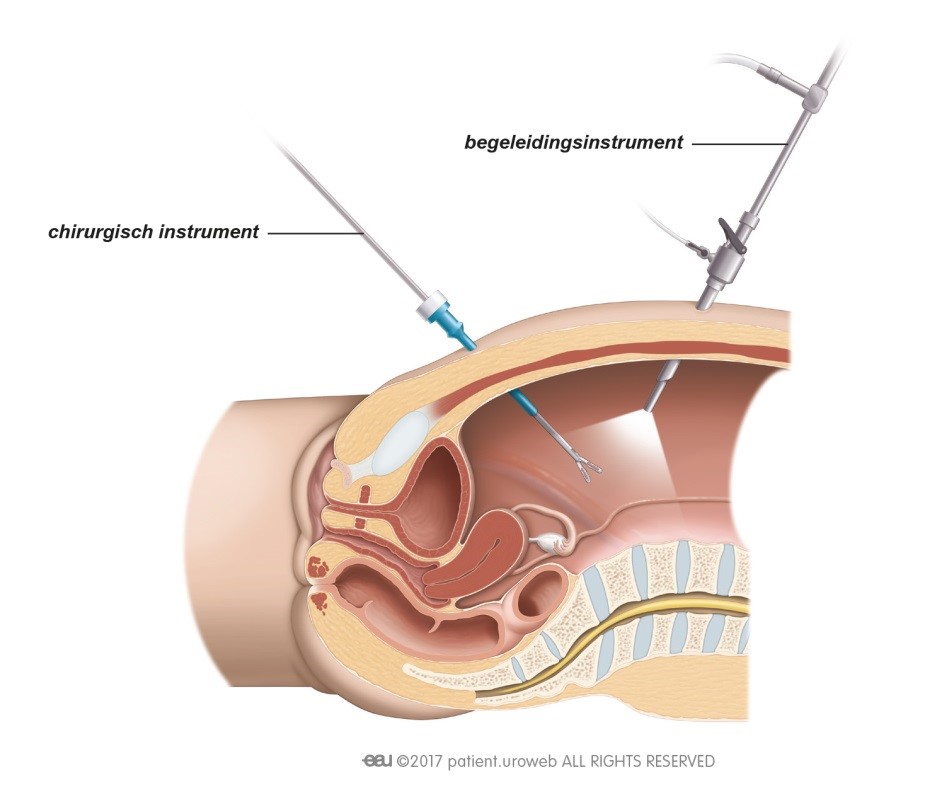
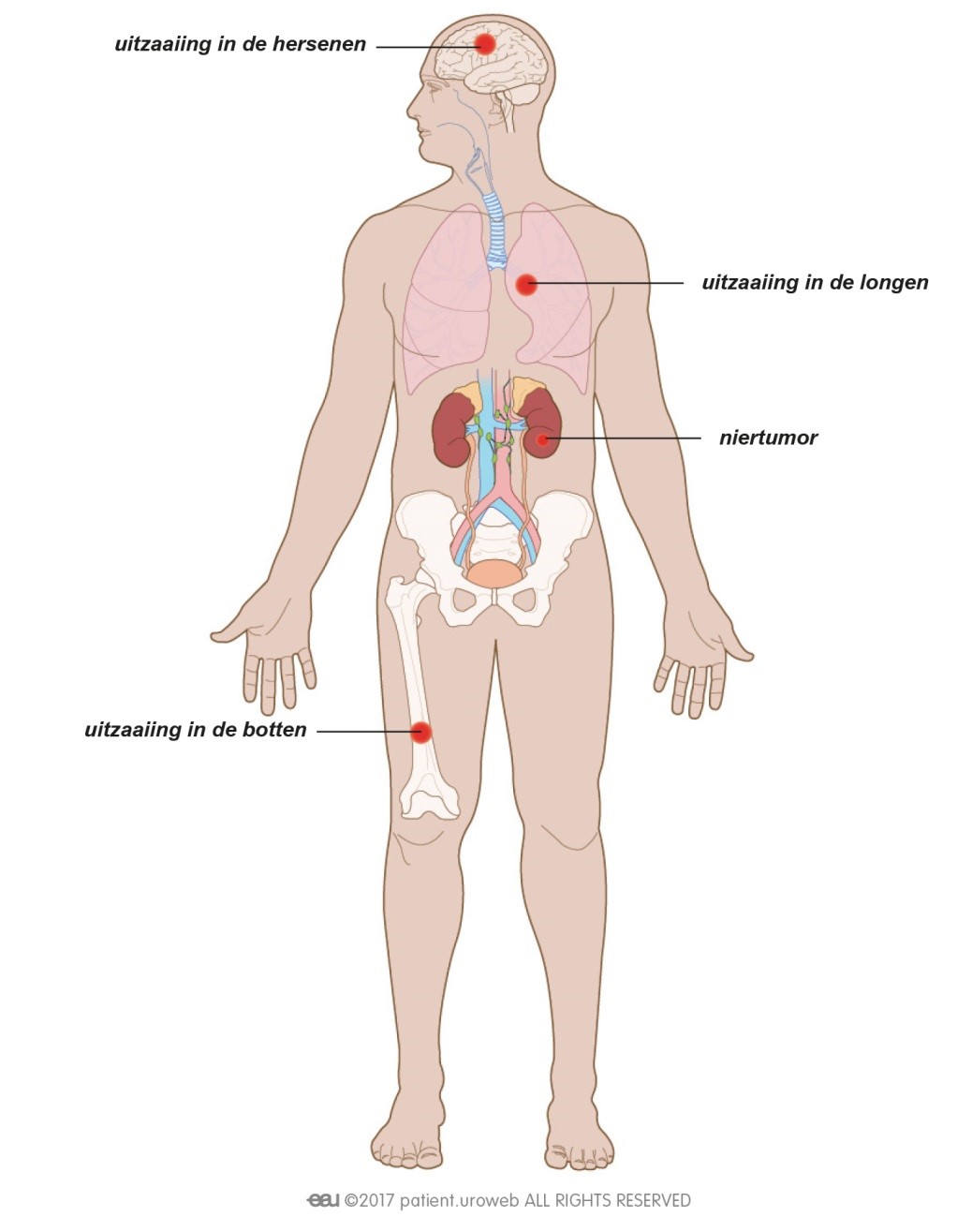
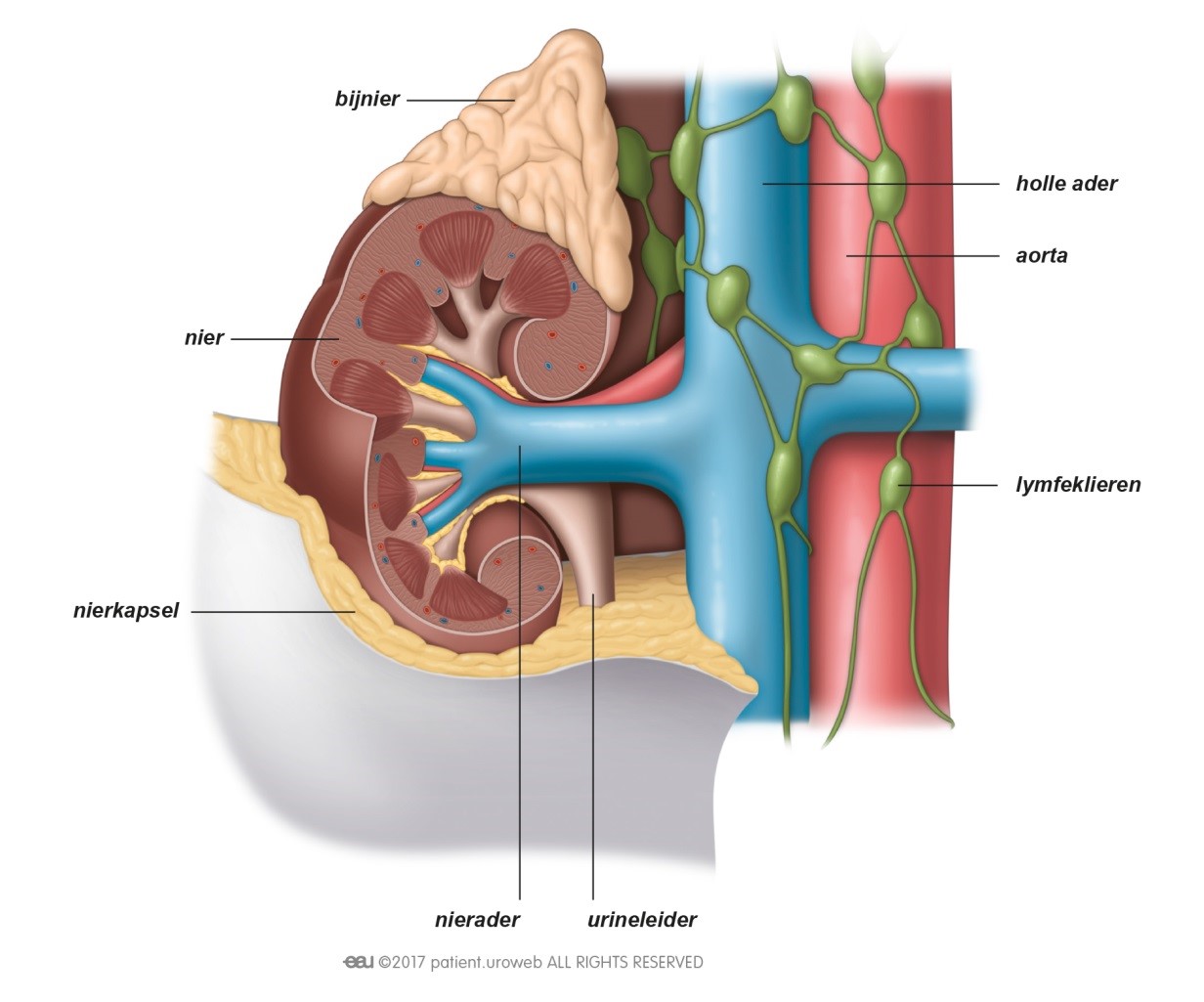
Dat een tumor is terug gekeerd, of dat er uitzaaiingen zijn, is natuurlijk heel slecht nieuws. Patiënten kunnen zich dan opnieuw veel zorgen maken over de prognose en de impact die de ziekte zal hebben op hun leven. Deze zorg kunnen ze met de arts of verpleegkundige bespreken. Om ervoor te zorgen dat de patiënt de allerbeste behandeling en begeleiding krijgt, zal er opnieuw overleg zijn tussen artsen met verschillende specialisaties. Dit behandelplan zal de uroloog of oncoloog met de patiënt bespreken.
Leefstijl
Met een gezonde leefstijl kunnen patiënten zelf het succes van een behandeling beïnvloeden. Steeds meer onderzoek toont aan dat voldoende bewegen, gezond eten en een gezond gewicht behouden, helpt voorkomen dat kanker opnieuw ontstaat. Gezond leven is ook van essentieel belang tijdens de behandeling. Het voorkomt verdere verzwakking en verbetert de conditie, waardoor patiënten een betere kwaliteit van leven hebben. Dit zal het succes van iedere behandeling verhogen. Van onderstaande factoren is in ieder geval duidelijk geworden dat ze de kans op het krijgen van kanker helpen te verlagen:
Niet roken
Roken is een van de grootste risicofactoren voor kanker. Veel vormen van kanker blijken vaker voor te komen bij rokers dan bij niet-rokers. En roken heeft meer nadelen. Het beschadigt hart en bloedvaten. Die negatieve effecten op de gezondheid worden nog eens versterkt doordat roken vaak samengaat met minder gezond eten, minder bewegen en meer alcohol. Stoppen met roken is het belangrijkste wat een patiënt kan doen om de kans op kanker te verkleinen. De vooruitgang in de gezondheid zal onmiddellijk merkbaar zijn. De huisarts kan de patiënt bij dit proces ondersteunen.
Voldoende lichaamsbeweging
Het effect van bewegen is aangetoond in meerdere wetenschappelijke studies: bewegen houdt de bloedvaten soepel, het hart sterk en het immuunsysteem actief. Een sportschool is niet per se nodig. Er zijn veel andere bewegingsvormen die eenvoudig in uw dagelijkse routine zijn in te passen. Elke soort lichaamsbeweging is goed, zowel matig intensief als intensief. Het beste is beide soorten af te wisselen.
Matig intensieve lichaamsbeweging
Onder matig intensieve lichaamsbeweging valt alles waarbij het hart iets sneller gaat kloppen en ook de ademhaling sneller gaat. Voorbeelden zijn stevig wandelen, rustig zwemmen, schoonmaken of fietsen.
Intensieve lichaamsbeweging
Onder intensieve lichaamsbeweging valt alles waarbij de hartslag omhoog gaat en de patiënt het warm krijgt, gaat zweten en buiten adem raakt. Voorbeelden hiervan zijn hardlopen, aerobics, fitnessen en teamsporten zoals voetbal of korfbal.
Gezonde voeding
Steeds duidelijker wordt dat overgewicht de kans op diverse vormen van kanker beduidend verhoogt. Hoe dat precies werkt, is nog niet bekend. Mogelijk leidt overgewicht vaker tot een lichte mate van chronische ontsteking in het lichaam. Dat ondermijnt ons afweersysteem, waardoor kankercellen meer kans krijgen. Daarnaast hangt overgewicht vaak samen met een ongezondere leefstijl (minder goede voeding, weinig beweging) wat het negatieve gezondheidseffect nog weer eens versterkt.
Geadviseerd wordt daarom een evenwichtig dieet aan te houden met:
- voldoende groenten, fruit en zuivel,
- zetmeelrijk voedsel zoals brood, aardappelen, rijst of pasta
- eiwitrijk voedsel, zoals vlees, vis, eieren of peulvruchten.
- minder suiker, zout en vet voedsel. Bij vragen kan de arts een doorverwijzing geven naar een diëtist.
Omgaan met de ziekte
De diagnose en behandeling van nierkanker is vaak erg emotioneel belastend. Hoe iemand er precies op reageert, is afhankelijk van vele factoren. Is er bijvoorbeeld kans op herstel, zijn de klachten ernstig, en zijn de behandelingen zwaar? Ook leeftijd en gezinssituatie kunnen de reactie op de ziekte beïnvloeden. Daarnaast speelt iemands karakter een rol. Wie al eerder in zijn leven te kampen kreeg met moeilijke situaties, heeft misschien een bepaalde manier gevonden om moeilijkheden het hoofd te bieden. Die aanpak kan dan ook helpen bij het verwerken van de ziekte. Sommigen vinden steun in hun geloof of levensovertuiging. Anderen zijn door de gebeurtenissen juist zo teleurgesteld of boos dat ze het vertrouwen in hun geloof verliezen. Ze raken daarmee een belangrijk houvast kwijt. De een heeft veel behoefte om over de ziekte te praten. De ander mijdt gesprekken hierover, omdat hij of zij gewend is de dingen zelf uit te zoeken. Sommigen mensen zijn van nature een makkelijke prater, maar vinden het in deze situatie toch moeilijk te vertellen wat in hen omgaat.
Juist in een moeilijke periode kan het goed zijn om de partner of een andere geliefde deelgenoot te maken van de gevoelens. Het kan de patiënt opluchten en het gevoel geven er niet alleen voor te staan. Ook voor mensen uit de omgeving is het prettig om te weten wat er speelt. Zij kunnen daardoor beter tot steun zijn.
Psychologische ondersteuning
Na de diagnose kan de patiënt zich behoorlijk zorgen maken. Zoals over de prognose, over de gevolgen van kanker op zijn of haar sociale leven, of over de gevolgen voor zijn financiële situatie. Dat is normaal, maar het kan soms blokkerend werken. Sommige patiënten vinden het moeilijk hun naasten met hun zorgen te belasten. Als de patiënt angstig blijft of zich geïsoleerd voelt, kan hij het best contact opnemen met zijn arts om te informeren naar hulp. Een verwijzing naar een psycholoog kan een uitkomst zijn. Een patiëntenorganisatie zoals Leven met blaas- of nierkanker kan ook ondersteuning bieden.
Ondersteuning op het gebied van financiën / zorgverzekering
Tijdens de behandeling kan de patiënt vaak niet werken. Het is verstandig om van tevoren met een leidinggevende te overleggen wanneer en hoe men weer aan het werk kan/zal gaan. Misschien is werken in deeltijd of in een andere functie mogelijk. De mogelijke financiële gevolgen van een behandeling kunnen worden besproken met arts of verpleegkundige. Zij kunnen verwijzen naar instanties waar individueel advies wordt gegeven. Ze kunnen ook helpen juridisch advies in te winnen over een testament en aanverwante zaken.
Op de website van het NIBUD is veel te vinden over financiële hulp en wat men zelf kan doen. Een kankerpatiënt komt soms voor onverwachte uitgaven te staan, bijvoorbeeld het aanschaffen van een pruik of een vergoeding voor ziekenvervoer. Het is belangrijk te weten of de zorgverzekering deze kosten dekt. Zo niet, dan kan men ieder jaar in december veranderen van zorgverzekering. Klik hier voor informatie over het afsluiten van een nieuwe zorgverzekering. Daarnaast mogen veel zorgkosten worden afgetrokken van de belasting als ze niet vergoed worden.
Ondersteuning voor familie en vrienden
De diagnose kanker beïnvloedt niet alleen de patiënt, maar ook de mensen om hen heen. Als partner, vriend, familielid of buurman is het mogelijk op verschillende manieren steun te bieden, bijvoorbeeld door te helpen met praktische zaken zoals wassen, tuinieren, of boodschappen doen. Het kan ook nuttig zijn om samen vragen te bedenken die tijdens het bezoek aan de arts gesteld kunnen worden. Door samen de arts te bezoeken, is het gemakkelijker zaken te onthouden, en zich te concentreren op details die dan achteraf samen besproken kunnen worden.
De diagnose en behandeling kunnen zeer emotioneel zijn voor alle betrokkenen. Behandeling van kanker is intens en je leven kan plotseling veranderen. Vragen over de prognose, de effecten van de behandeling, en zelfs de mogelijkheid van sterven kunnen ter sprake komen. Een vriend of geliefde kan steunen door te luisteren en hoeft niet de antwoorden klaar te hebben. Patiëntenorganisaties bieden ook ondersteuning voor familieleden of vrienden van de mensen die zijn gediagnosticeerd met kanker.
Palliatieve zorg
In de laatste fase van de kanker, wanneer behandelingen geen effect meer hebben, zullen artsen de patiënt palliatieve zorg bieden om het leven comfortabeler te maken. Tijdens de palliatieve zorg worden de patiënt en zijn dierbaren ondersteund door een multidisciplinair team. Gezamenlijk bieden de teamleden fysieke, psychische, sociale en spirituele ondersteuning. Palliatieve zorg omvat het beheersen van symptomen en pijnbestrijding, bijvoorbeeld met morfine. Palliatieve zorg kan in het ziekenhuis, thuis of in een hospice plaatsvinden. Een hospice is een instelling die zorg verleent tijdens de laatste fase van het leven.