Hoe werkt radiotherapie?
Radiotherapie schaadt en doodt cellen en wordt gebruikt om kankercellen te bestrijden. Prostaatkankercellen reageren in de meeste gevallen op radiotherapie. Er zijn 2 soorten radiotherapie:
- uitwendige radiotherapie (door de huid heen)
- inwendige radiotherapie (van binnenuit). Dit wordt ook wel brachytherapie genoemd.
Door continue verbeteringen in de bestralingstechnieken is het een effectieve behandeling voor gelokaliseerde prostaatkanker.
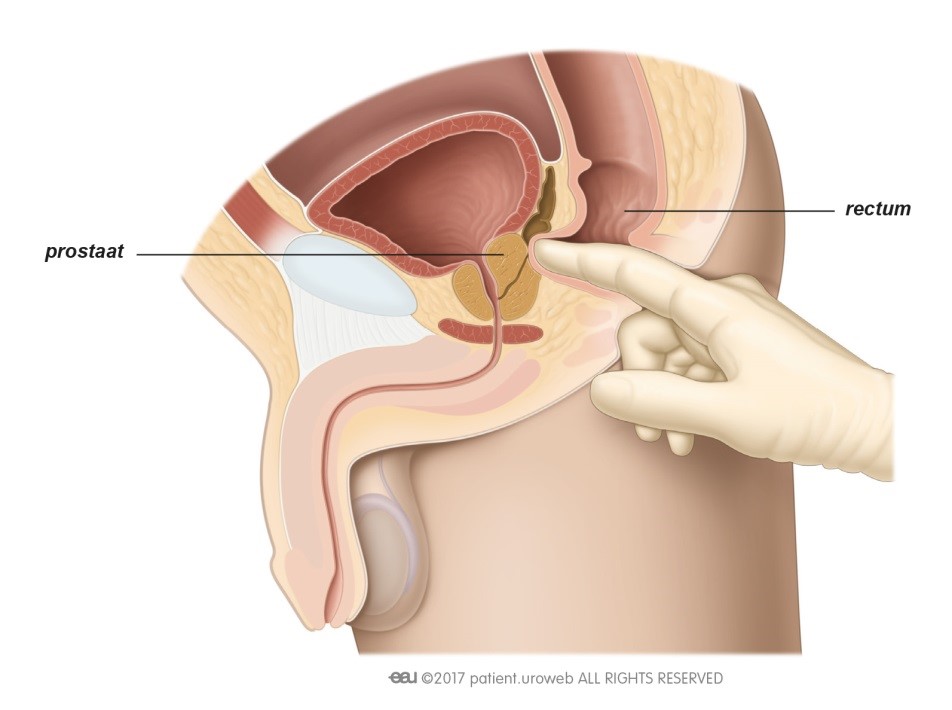
De arts geeft informatie hoe het beste op de procedure kan worden voorbereid. Een eet- en drinkschema wordt vóór elke sessie aangeboden om te zorgen dat de blaas vol en het rectum (dat is het laatste stuk van de darm) leeg is voordat de procedure van start gaat. Medicatiegebruik moet besproken worden met de arts.
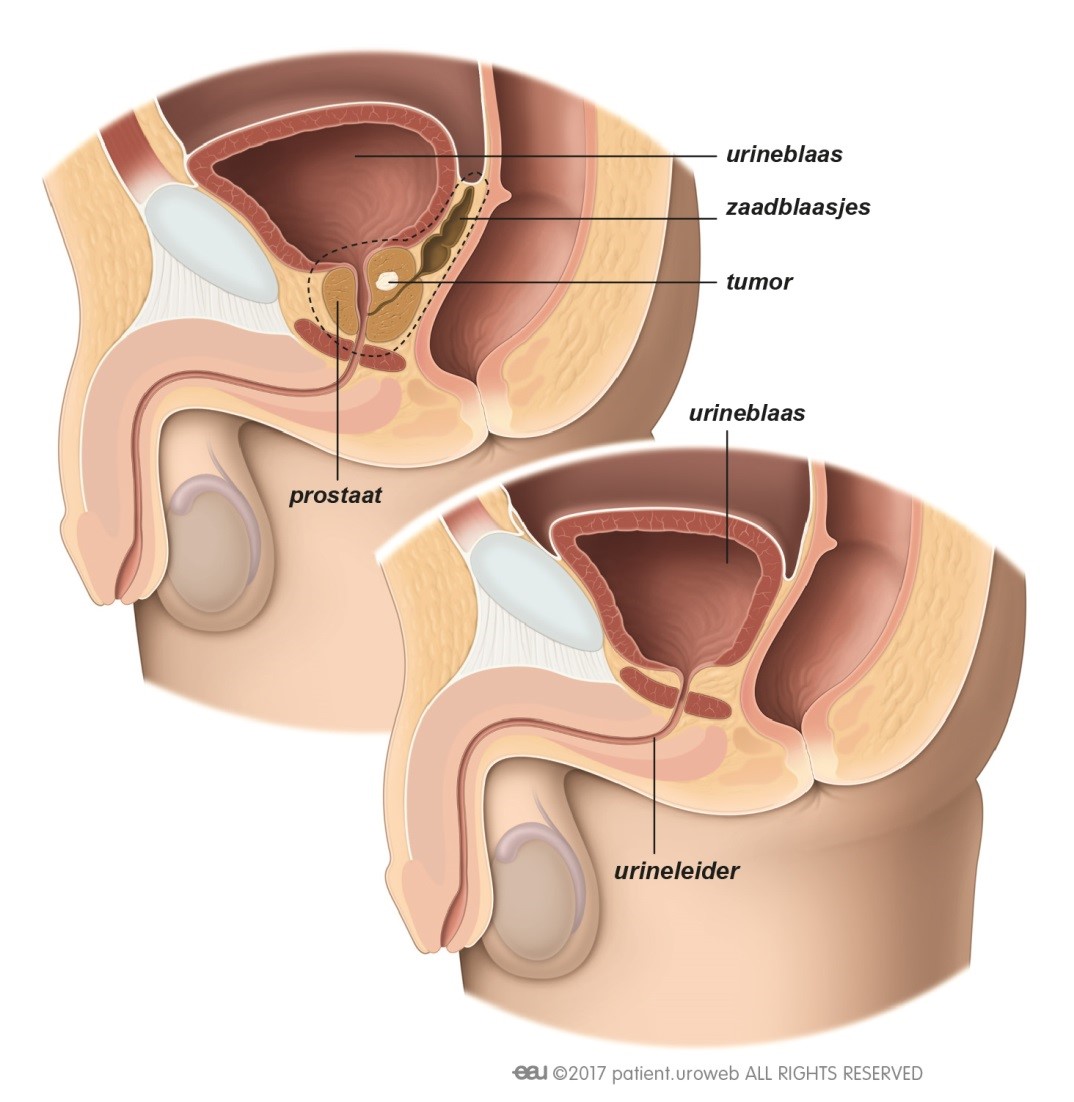
Als tijdens controle van de PSA-waarde in het bloed blijkt dat de prostaatkanker niet volledig is weg is, kan de arts aanbevelen om alle tumorcellen te verwijderen. De behandelingsmogelijkheden zijn:
- Salvage radicale prostatectomie (‘salvage’ naar het Engelse woord voor redding)
- Salvage brachytherapie (geen optie na radicale prostectomie)
- Hormoontherapie
Bijwerkingen
Door verdere ontwikkelingen in de bestralingstherapie neemt de precisie van de bundel toe, en kan een hogere dosering van bestraling worden toegepast met minder bijwerkingen. Vaak voorkomende bijwerkingen zijn een branderig gevoel bij het plassen, vaak moeten plassen, en anale irritatie. Dit komt omdat de omliggende organen, met name de blaas en het rectum, ook radioactieve straling ontvangen. Meestal verschijnen deze symptomen halverwege de kuur en verdwijnen deze weer enkele maanden nadat de radiotherapie is beëindigd. Een veel voorkomende bijwerking van radiotherapie is bloeding in de blaas en het rectum, zelfs jaren na de behandeling. U kunt ook lagere urineweg symptomen (LUTS) ervaren (plasklachten), of erectiestoornissen. Hoe hinderlijk de bijwerkingen van stralingstherapie zijn, en wanneer ze verschijnen, dat verschilt van persoon tot persoon. Dit hangt samen met uw algemene gezondheid en met welke bestralingstherapie wordt toegepast.
De patiënt kan tijdens de radiotherapiebehandeling meestal doorgaan met de dagelijkse activiteiten. De behandeling kan leiden tot vermoeidheid door de dagelijkse trips naar het ziekenhuis en kan de lagere urinewegen en de darm beïnvloeden. De huid kan door de bestraling beschadigd raken. De (huis)arts of verpleegkundige kan hier tips over geven. Het is bijvoorbeeld belangrijk dat de huid niet wordt blootgesteld aan zon of saunabezoek.
Uitwendige radiotherapie
Bij uitwendige bestraling wordt de straling in speciale apparaten opgewekt. De tumor wordt van buitenaf (door de huid heen) bestraald. De stralenbundel wordt zo gericht dat het gezonde weefsel om de tumor heen zo weinig mogelijk straling krijgt. Na de bestraling blijft er geen straling in het lichaam achter. De patiënt hoeft niet in het ziekenhuis opgenomen te worden. Er is een bepaalde dosis straling nodig om een tumor te vernietigen. Dat kan niet in 1 keer omdat het gezonde weefsel daar teveel door beschadigd wordt. De straling wordt in kleine doses gegeven, zodat gezonde cellen zich steeds kunnen herstellen. Kankercellen kunnen dat minder goed en sterven geleidelijk af.
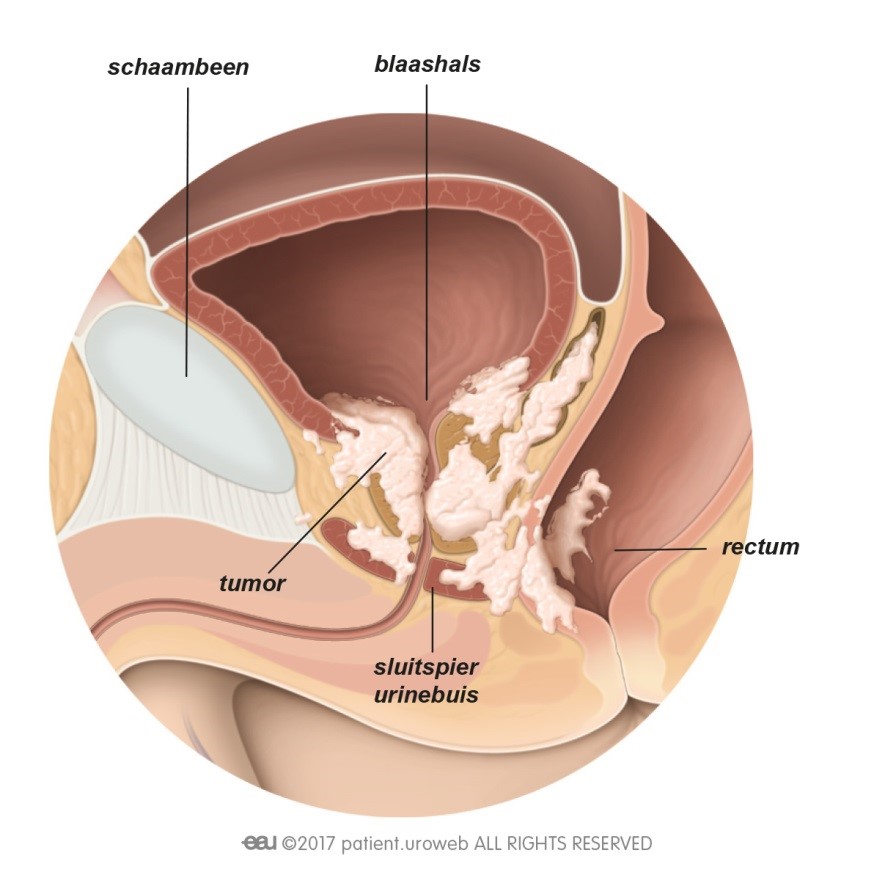
Uitwendige bestraling [Fig. 12] duurt ongeveer 8 weken, 5 dagen per week. Er wordt één stralingsdosis per dag gegeven. De behandeling duurt ongeveer 20 minuten. Alvorens met radiotherapie te starten zal eerst een CT scan worden gemaakt. Dit wordt gedaan om het bestralingsgebied, alsook het omringende weefsel dat níet moet worden behandeld, in kaart te brengen. In de afgelopen jaren is het gebruik van beeldgeleide radiotherapie wereldwijd toegenomen. Voor een dergelijke behandeling lokaliseert de oncoloog met behulp van een röntgenfoto of CT scan de lager gelegen urinewegen die zeer nauwkeurig moeten worden bestraald. Ook worden er gouddeeltjes ingebracht als referentiepunten om de bestraling te optimaliseren.
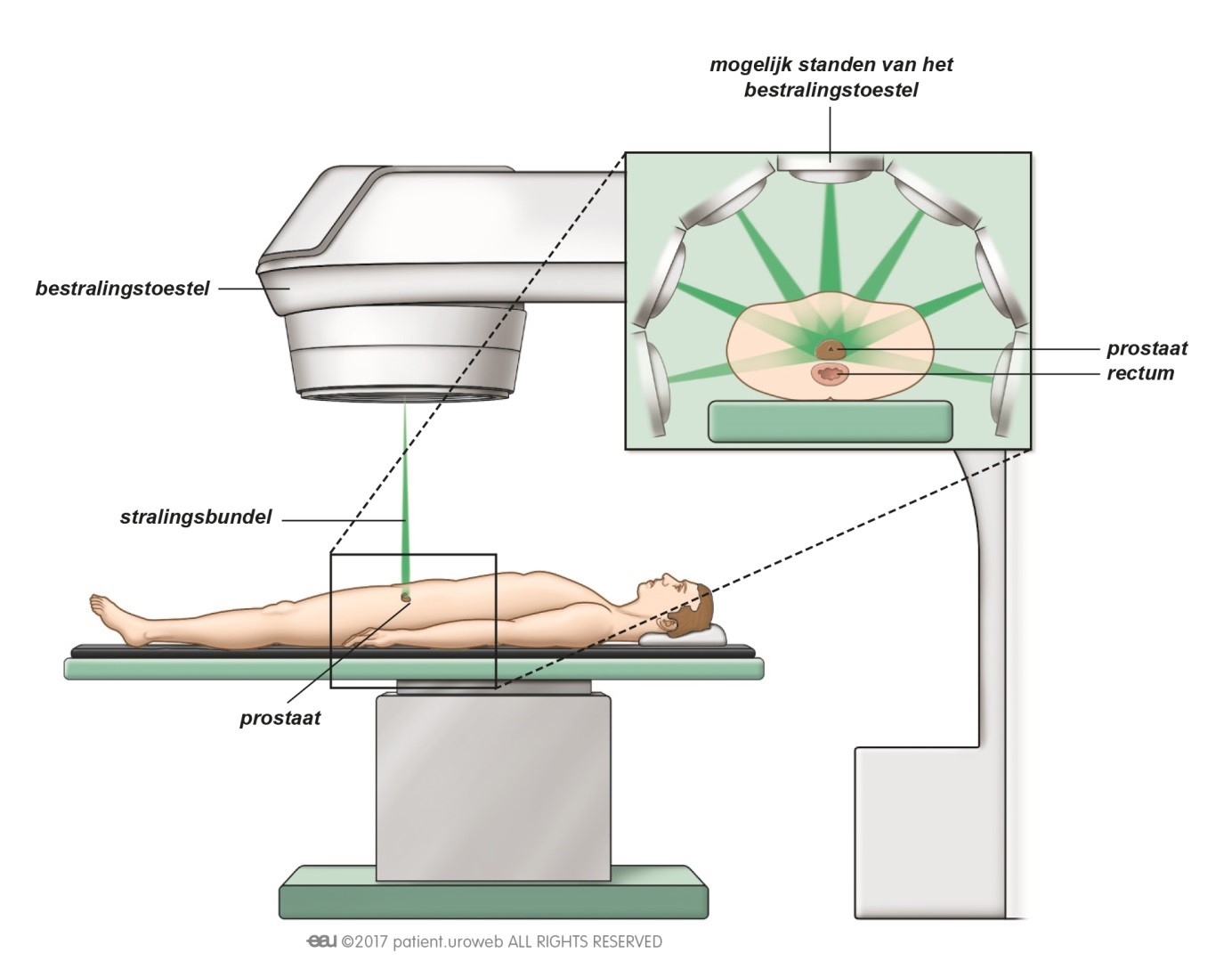
Fig. 12: Uitwendige bestraling beschadigt en doodt kankercellen.
Indicaties uitwendige radiotherapie
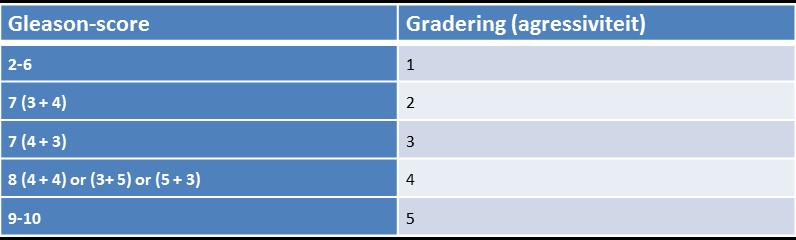
Uitwendige radiotherapie als behandeloptie voor patiënten met gelokaliseerd prostaatcarcinoom wordt afgewogen tegen de verschillende andere behandelopties, waaronder radicale prostatectomie en brachytherapie en ook tegen actief volgen of waakzaam afwachten. Bij gelokaliseerde prostaatkanker met een hoge Gleasonscore, kan de arts uitwendige radiotherapie aanraden in combinatie met hormonale therapie.
Inwendige radiotherapie (brachytherapie)
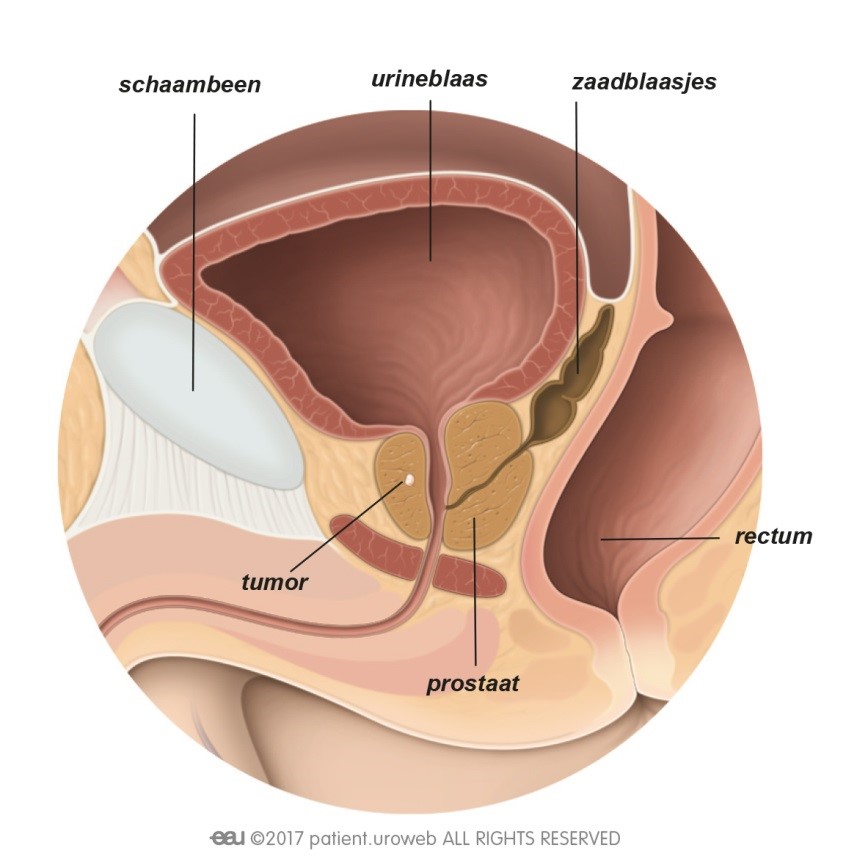
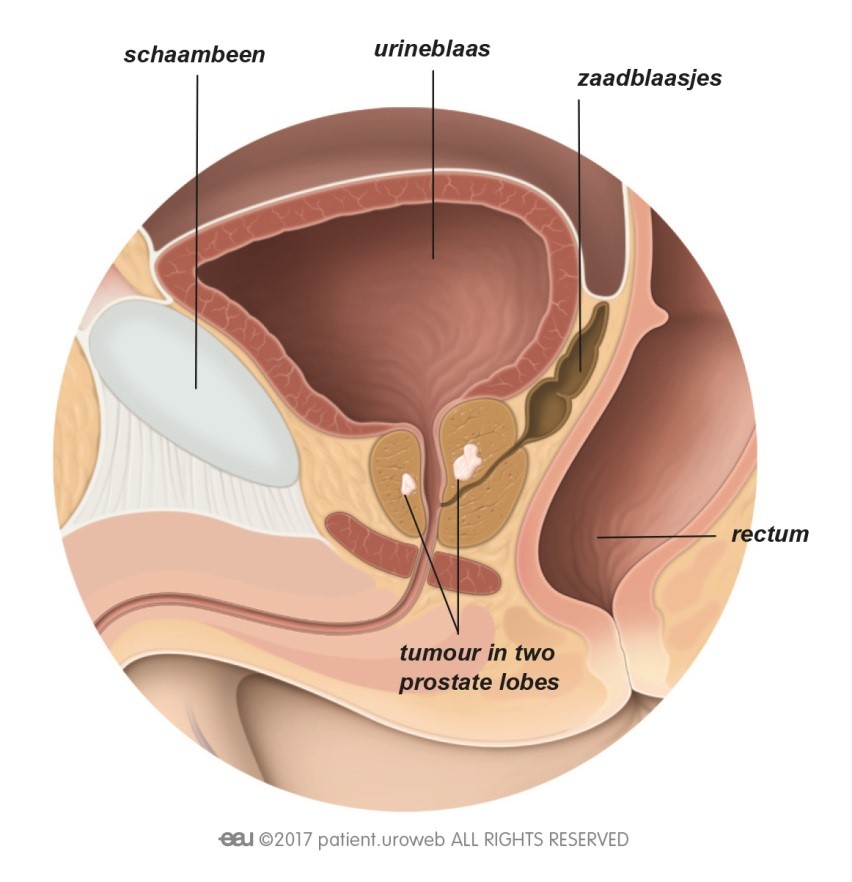
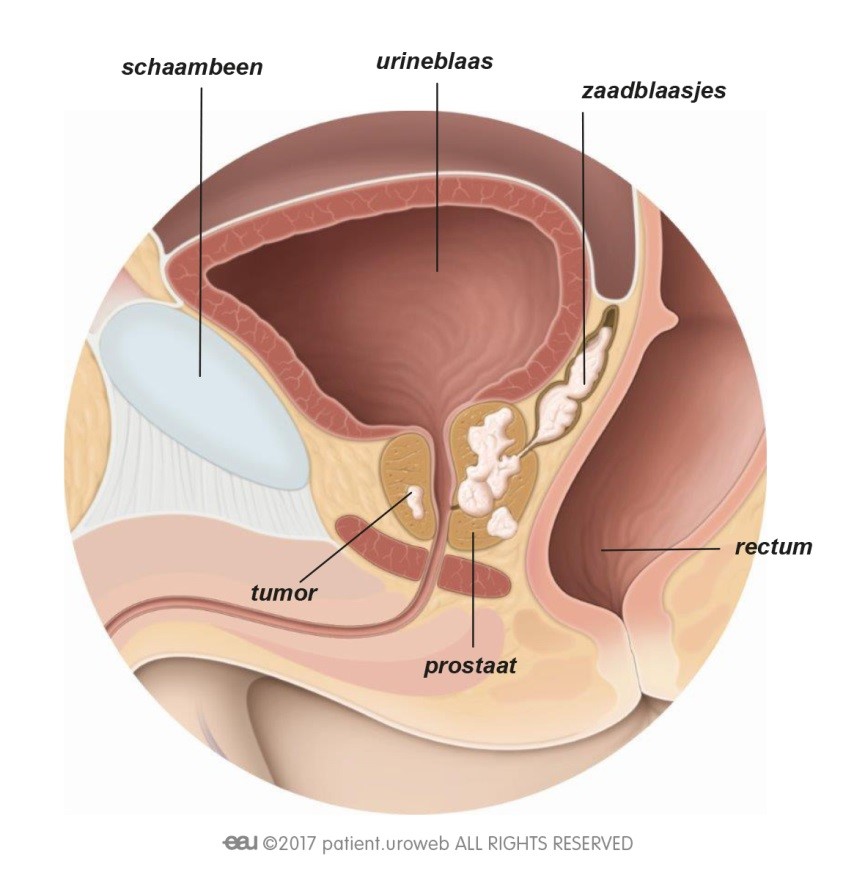
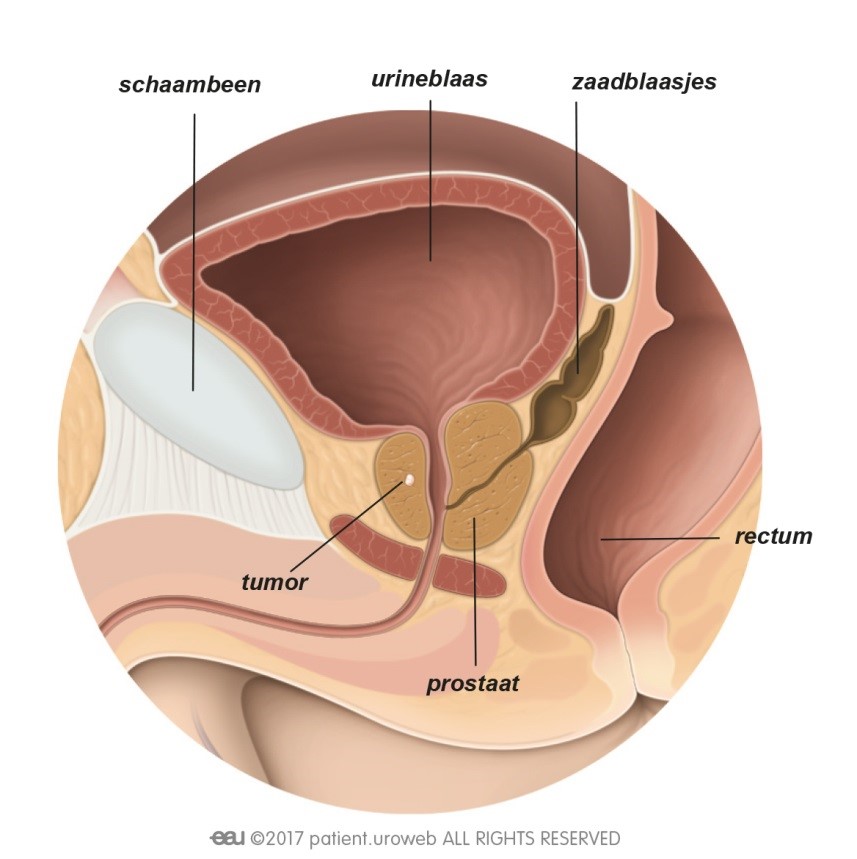
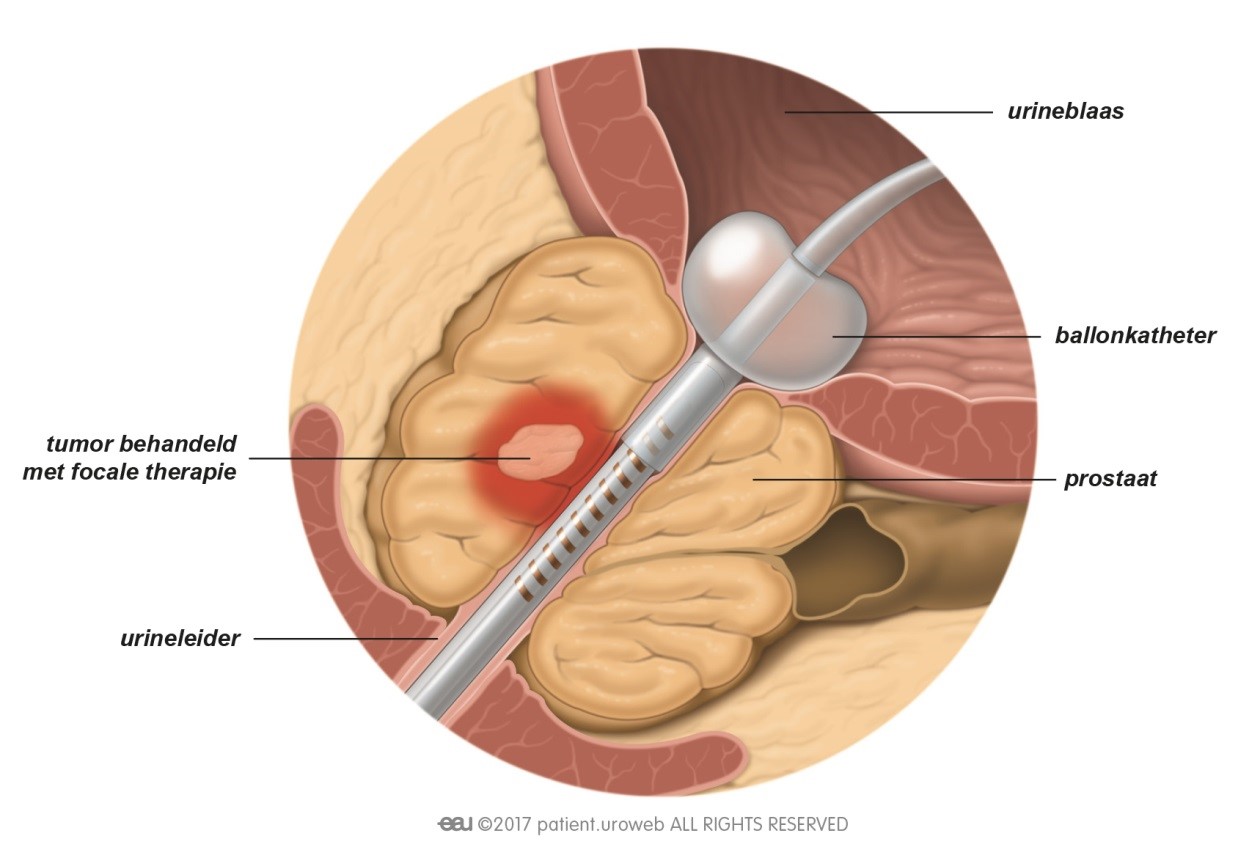
De meest toegepaste brachy methode maakt gebruik van radioactieve implantaten (zaadjes) die door de bestralingsarts dichtbij of in de tumor in de prostaat worden geplaatst [Fig. 13]. De uit die zaadjes voortkomende straling doodt de kankercellen. Tegenwoordig worden ook wel andere vormen van brachy toegepast (HDR ofwel hoge dosis brachy of brachy met slechts een enkele dosis), maar die maken (nog) geen onderdeel uit van de hier toegelichte richtlijnen.
Inwendige bestraling is alleen mogelijk als de tumor gemakkelijk bereikbaar is. Het voordeel is dat de arts een hoge dosis straling kan geven op een klein gebied. Dit geeft minder risico op schade aan het gezonde weefsel (en dus op bijwerkingen) dan bij uitwendige bestraling.
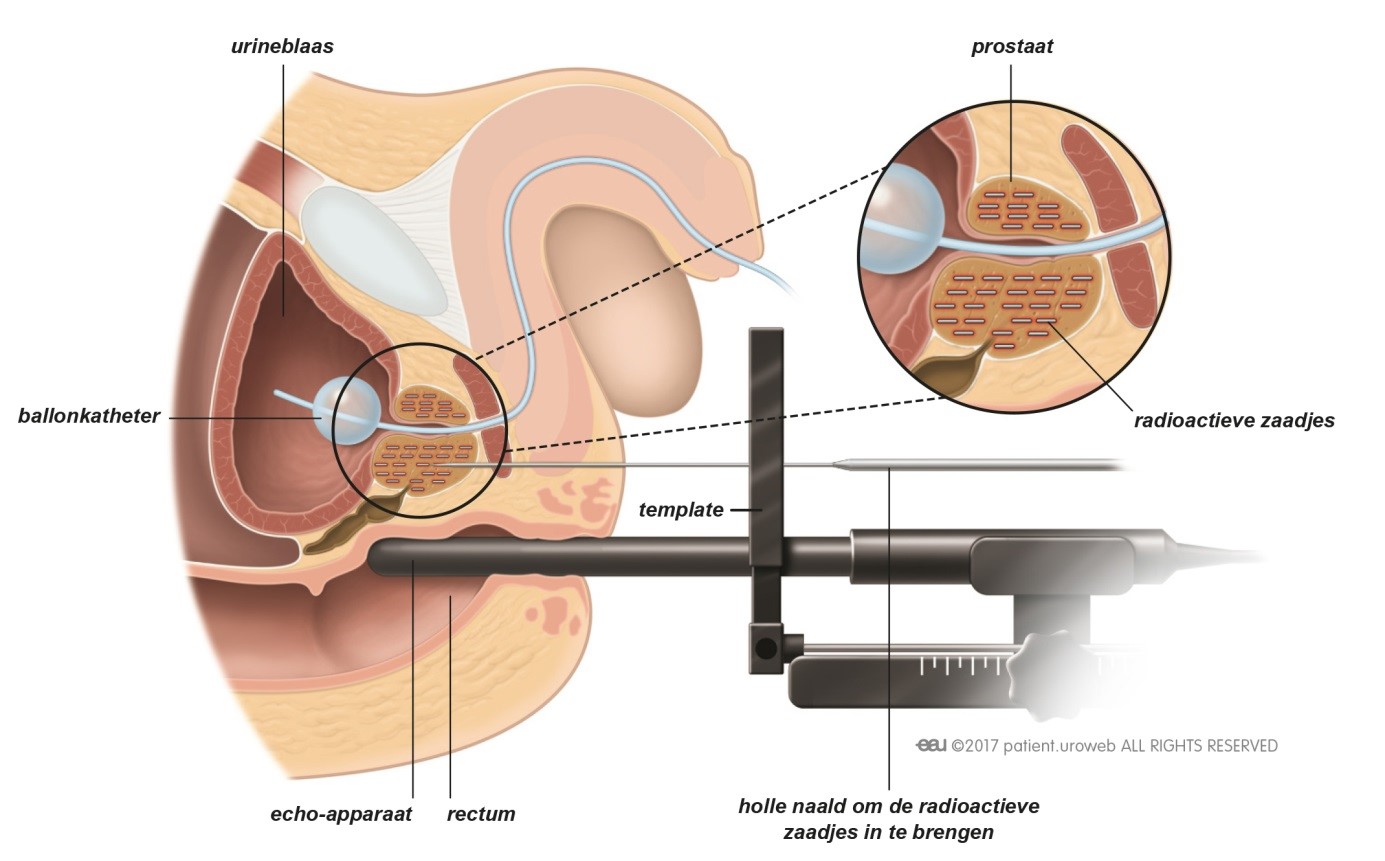
Fig. 13: Bij inwendige bestraling wordt de stralingsbron rechtstreeks in de prostaat gebracht.
Indicaties inwendige radiotherapie
Inwendige bestraling bij prostaatkanker is mogelijk als:
- de tumor beperkt is gebleven tot de prostaat
- de prostaat niet te groot is (max. ongeveer 50 ml)
- de PSA-waarde in het bloed niet hoger is dan ongeveer 15
- de tumor niet te agressief is: Gleasonscore van maximaal 7
- er vooraf geen ernstige plasklachten zijn
Combinatie van radiotherapie en hormoontherapie
Hoe werkt de combinatie van radio- en hormoontherapie?
Bij lokale prostaatkanker met een hoge Gleasonscore kan radiotherapie in combinatie met hormoontherapie geadviseerd worden. De resultaten van de behandeling met alleen radiotherapie is voor deze groep teleurstellend. De uroloog zal hierover adviseren.
Indicaties combinatie radio- en hormoontherapie
Bij prostaatkanker in een lage risicogroep is de toevoeging van hormonale therapie aan radiotherapie niet zinvol en is de kans op genezing in ieder geval uitstekend. Voor de hoge risicogroep geeft langdurige hormonale therapie waarschijnlijk een betere kans op overleving. De duur van hormoontherapie ligt niet vast maar is, afhankelijk van de Gleasonscore, minimaal 6 maanden tot maximaal 3 jaar. Als de hormoontherapie zwaar is voor een patiënt kan de duur worden verkort.